GLP-1受容体の細胞外表面はバイアスされたアゴニスト作用の分子トリガーである
The Extracellular Surface of the GLP-1 Receptor Is a Molecular Trigger for Biased Agonism
Ligand-directed signal bias offers opportunities for sculpting molecular events, with the promise of better, safer therapeutics.
リガンドが方向づけるシグナルバイアスによって、より優れた安全性の高い治療につながる見込みのある分子イベントを作り出す機会がもたらされる。
Critical to the exploitation of signal bias is an understanding of the molecular events coupling ligand binding to intracellular signaling.
シグナルバイアスを開発するためには、リガンド結合を細胞内シグナル伝達と共役させる分子イベントの理解が重要である。
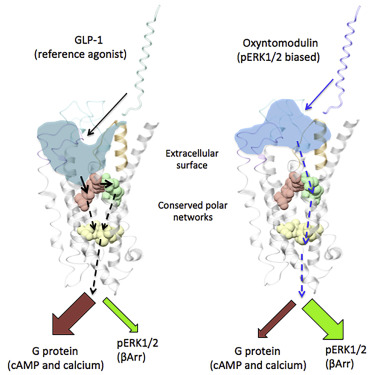
Activation of class B G protein-coupled receptors is driven by interaction of the peptide N terminus with the receptor core.
クラスBのGタンパク質共役受容体の活性化は、N末端ペプチドと受容体のコアとの相互作用によって進行する。
To understand how this drives signaling, we have used advanced analytical methods that enable separation of effects on pathway-specific signaling from those that modify agonist affinity and mapped the functional consequence of receptor modification onto three-dimensional models of a receptor-ligand complex.
この相互作用がどのようにしてシグナル伝達を進行するかを理解するため、アゴニストの親和性を変更する効果と経路特異的なシグナル伝達に対する影響を分離し、そして受容体修飾による機能的な結果を受容体-リガンド複合体の3次元モデルにマッピングすることが可能となる先進的な分析方法を使用した。
This yields molecular insights into the initiation of receptor activation and the mechanistic basis for biased agonism.
この方法によって、受容体活性化の開始やバイアスされたアゴニスト作用の基本メカニズムについての分子的洞察が得られる。
Our data reveal that peptide agonists can engage different elements of the receptor extracellular face to achieve effector coupling and biased signaling providing a foundation for rational design of biased agonists.
我々のデータは、ペプチドアゴニストが受容体の細胞外表面の異なる要素にエフェクターカップリングをもたせ、バイアスされたアゴニストの合理的な設計の基盤をもたらすバイアスされたシグナル伝達を獲得させることが可能であることを、明らかにしている。
-Volume 165, Issue 7, p1632–1643, 16 June 2016 Cell