関節リウマチや敗血症性ショック、アレルギーなど免疫異常の病気の引き金となるタンパク質「IL-18」と受容体との複合体の立体構造を解明したと、岐阜大と京都大の研究チームが発表した。15日付の英科学誌ネイチャー・コミュニケーションズに論文が掲載された。
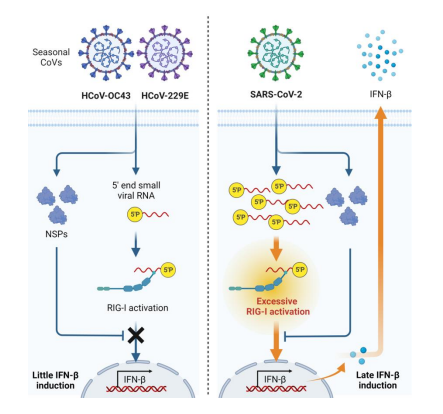
IL-18(インターロイキン-18)は細菌やウイルスの感染から体を守るためリンパ球などが放出するタンパク質で、血液中を流れて炎症などの生体反応をコントロールする。通常は病原体を排除する働きをするが、過剰に生産されると多くの免疫異常の病気を引き起こす原因となる。
IL-18は細胞表面に存在する2つの受容体(α、β)と結合して作用する。しかし2つの受容体の詳細な構造は分かっておらず、どのように結合するかが不明であったためIL-18の作用を抑制する薬の開発が難しかった。
研究チームはIL-18や2つの受容体を遺伝子組換え技術をつかって昆虫由来の細胞に作らせ、これらの複合体を得ることに成功した。複合体は高純度に精製して結晶化し、X線結晶構造解析法によって原子レベルでの立体構造の解明に成功した。
その結果、IL-18はまず受容体αと結合してから受容体βと結合して複合体を形成する仕組みが明らかになった。IL-18と受容体を結合させる部位も詳細に判明した。あらかじめこの部位に原始を挟み込むことで結合を邪魔する新薬の開発にも着手している。詳細な立体構造が明らかになったことで薬の原子構造を設計しやすくなるという。
リウマチやアレルギーなどの治療に使用されるステロイドなどの免疫抑制剤は、IL-18と受容体の複合体が形成されて細胞内で働いたあとに発症を抑える薬であり、副作用に課題があった。しかし複合体の形成を邪魔する新薬ができれば細胞外の段階で抑えることができるため、副作用が出にくいという利点があるという。
参考:岐阜新聞















































 速読力をアップする方法
速読力をアップする方法
 脳力をアップする方法
脳力をアップする方法
 英語力をアップする方法
英語力をアップする方法